Cell突破 | 首次实现活细胞单基因转录可视化
2019-06-04 21:05:22
转录是以DNA为模板合成RNA的过程,作为中心法则中的重要环节,其调控一直是生物学研究中的热点。真核生物的转录调控涉及到的蛋白众多,包括RNA聚合酶II、转录因子(Transcription factor)、中介因子复合体(Mediator)、chromatin reader/remodeler等。由于涉及的蛋白多、细胞核内结构复杂,所以如何研究细胞内的转录调控机制,一直是一项巨大的挑战。利用超分辨显微镜在活细胞体内直接对单个基因的转录事件进行观察分析,一直是研究人员的梦想。在此之前,相关研究主要集中在细胞内构建高拷贝基因芯片观测Pol II的动态,或者利用超分辨显微镜PALM(Live cell photo activation)提高活体分辨率。这两种方法都有较为明显的局限性:前者的问题是基因芯片是人为合成的具有重复区段的转录系统,虽然可以增强信号,但它无法真正代表内源基因;后者则由于无法标记大部分荧光分子因而很难实时监测单个基因的转录事件。
2019年5月30日,美国纽约纪念斯隆-凯特琳癌症中心结构生物学系Alexandros Pertsinidis课题组在Cell上发表了题为Single-Molecule Nanoscopy Elucidates RNA Polymerase II Transcription at Single Genes in Live Cells的研究论文,研发了一项结合3D STED(stimulated emission depletion)和target-locking的新型高灵敏单分子荧光成像技术,在活细胞体内首次监测了精确到单个基因位点上的转录事件,并实现了对RNA聚合酶II (Pol II)、转录调控因子(Regulatory Factors, RF)以及內源转录本的实时定量分析,揭示了真核细胞转录调控网中各种组分的分子调控机理,为深入了解转录调控提供了重要工具。
为了克服上述方法的局限,Pertsinidis课题组研发了一类全新的超分辨成像技术:通过构建3D STED超高分辨率显微镜,再结合target-locking技术,研究人员首次在活细胞内观测到了单一内源基因上的转录事件。
研究人员在小鼠干细胞中利用特异的RNA 探针分别标记了两个单一拷贝的内源基因(Pou5f1和Nanog)的转录本,他们实时监测、追踪并且对这两个特异基因位点上的Pol II和调控因子RF(Sox2, Brd4, Cdk9, Med22)进行了绝对定量。结果显示,在Pou5f1位点上,Pol II信号和调控因子 RF 信号并非精确共定位。相比Pol II,调控因子距离 3' UTR RNA探针更远,这表明这四种调控因子主要分布在距离转录本较远的增强子区域。相关药物处理以及定点FRAP(Fluorescence Recovery After Photobleaching)实验证明,Pou5f1上的Pol II主要参与了转录延伸(transcription elongation)和终止(transcription termination)过程,Pol II参与转录后立即被释放,并没有被回收利用(recycling)。
此外,实验结果显示通过施加不同浓度的Brd4抑制剂 JQ1,可以调控增强子区域Brd4 信号强弱进而影响Pou5f1转录本活性高低。这一结果证明了增强子区域的调控因子直接参与了靶基因的转录调控。有趣的是,研究人员还发现不同基因对于JQ1的响应也不尽相同:Nanog基因增强子区的Brd4信号强弱控制了该基因的转录频率(bursting frequency)。
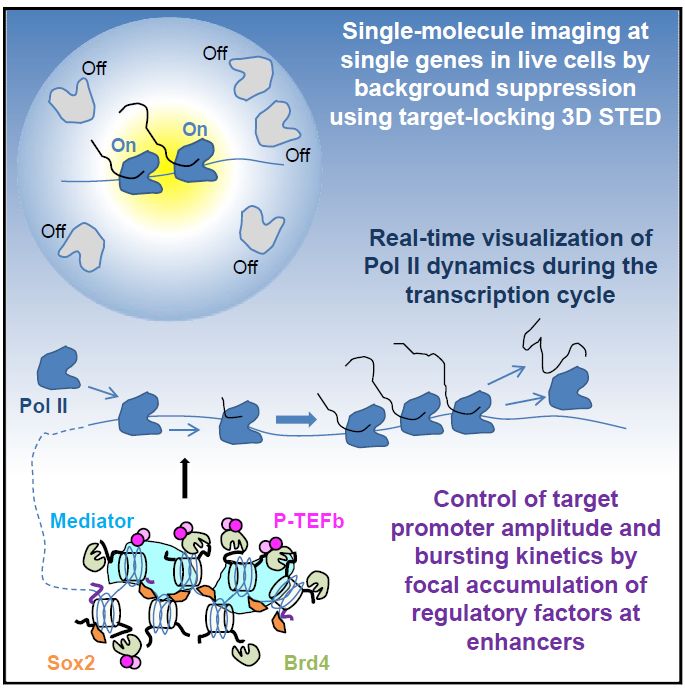
该研究表明,活细胞内的转录调控可能比人们目前所知的更为复杂、更加精细。而此文中报道的新型超高分辨率显微镜,为人们进一步研究相关分子机制提供了强有力的工具。
原文链接:
https://www.cell.com/cell/fulltext/S0092-8674(19)30557-4
https://www.cell.com/cell/fulltext/S0092-8674(19)30557-4
本文转载自其他网站,不代表本学会观点和立场。如有内容和图片的著作权异议,请及时联系我们。

