细胞制剂车间设计要点与问题分析
2020-01-08 19:28:35
| 细胞制剂车间设计要点与问题分析 张叔人 中国医学科学院、北京协和医学院肿瘤医院肿瘤研究所 Good Manufacture Practice(GMP) 良好操作规范 GMP是世界卫生组织(WHO),对所有制药企业质量管理体系的具体要求,1992年实施。 我 国 《 药 品 生 产 质 量 管 理 规 范 》 ( Good Manufacture Practice of Medical Products,GMP)根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》, 制定本规范。1999年8月1日起施行(导致1112家企业倒闭) 。 新版《药品生产质量管理规范(2010年修订)》 自2011年3月1日起施行(500家中小企业关停) 。新版GMP已经与世界卫生组织药品GMP一致。 Good Manufacture Practice(GMP)良好操作规范 GMP三大要素是人员、硬件和软件。 人员是关键,硬件是基础,软件是保证 。 优秀的机构人员、与生产质量相适应的硬件、完 善可行的软件构成了生产合格药品的基本保证 1997年发布《医药工业洁净厂房设计规范》(简称GMP 设计规范);2009年实施 《医药工业洁净厂房设计规范》 GB50457-2008; 《药品生产质量管理规范(2010年修订)》2011年3月1日起施行。 干细胞临床研究管理办法(试行) 国家卫生计生委会同食品药品监管总局联合 国卫科教发〔2015〕48号2015年07月20日发布 第十七条 …… 干细胞制剂的制备应当符合《药品生产质量管理规范》(GMP)的基本原则和相关要求,配备具有适当资质的人员、适用的设施设备……最大限度地降低制备过程中的污染、交叉污染,确保持续稳定地制备符合预定用途和质量要求的干细胞制剂。 体细胞制剂特点 规模小:个体化制剂(或批量制剂) 多批样品同期制备,增加交叉污染和混肴差错几率。 理、化因素对制剂影响大,终产品不能灭菌处理。 有些含有冻存和复苏程序。 有些终制剂进入人体前不能完成所有检测。 终制剂有效期短。 细胞制剂与其他生物制剂的不同点
自体血液骨髓来源的细胞与 异体组织来源的干细胞制剂的不同点
体细胞制剂室位置的选择 应建立在自然环境良好的区域,应远离空气严 重污染、水质严重污染或病原微生物(含未知 或无检测手段的病原微生物)丰富的场所,应远离振动或噪声干扰的区域; 独立或相对独立 应建立并实施防虫、防鼠、防花粉等措施,防止无关动植物进入关键区域。 空气净化《医药工业洁净厂房设计规范》 GB50457-2008
新版各级别空气悬浮粒子的标准 2010年新版GMP 附录1无菌药品 GMP不同国家有不同标准,ISO国际统一标准
98年版与2010年版GMP洁净区各级别空气悬浮粒子标准对照
注:(1)表中各数值均为平均值。(2)单个沉降碟的暴露时间可以少于4 小时,同一位置可使用多个沉降碟连续进行监测并累积计数。 《GMP附录-细胞治疗产品》征求意见稿食品药品审核查验中心
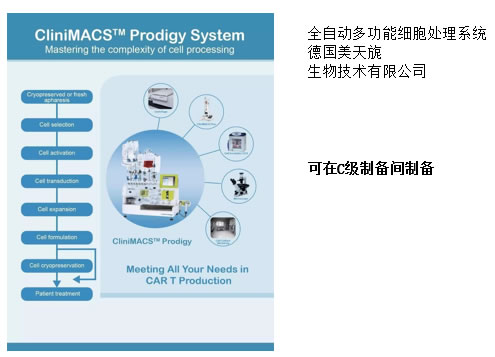
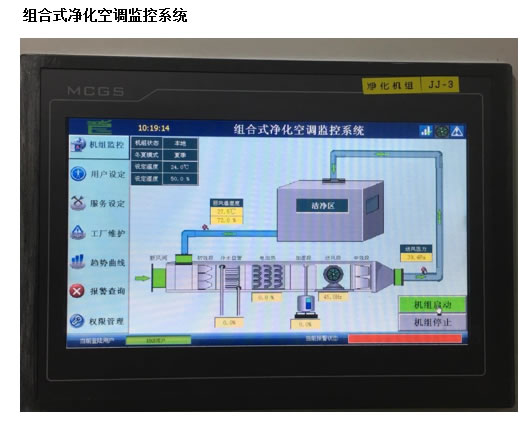
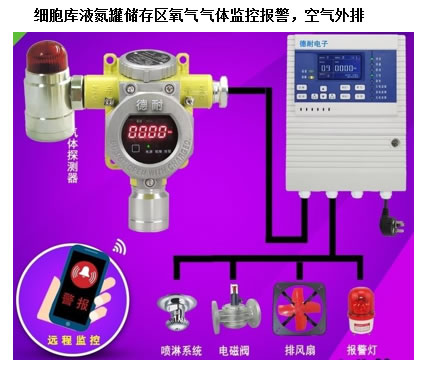
空气净化 细胞制剂制备质量管理自律规范(中国医药生物技术协会) 干细胞制剂:第三十五条 应按照工艺规程设计相应操作区的洁净度级别,非完全密封状态下的细胞操作(如分离、培养、灌装等)以及与细胞直接接触的无法终端灭菌的试剂和器具的操作,应在 B 级背景下的 A 级环境中进行。 在隔离系统或密闭自动制备系统可采用C+A。 干细胞有些来源于暴露于外环境的组织(如脐带、 胎盘等),应有独立的预处理间,检测合格后再进 入生产制备区。 洁净室内的温度和湿度应符合下列规定GB50457-2008 生产工艺对温度和湿度无特殊要求时, 以穿着洁净工作服不产生不舒服感为宜。 100级、10000级区域:温度为20~24℃, (A级 C级) 相对湿度为45~60%。 100000级区域: 温度为18~28℃ (D级) 相对湿度为50~65%。 噪音控制GB50457-2008 非单向流医药洁净室的噪声级不应大于60dB,单向流和混合流医药洁净室的噪声级不应大于65dB。 单向流:百级风幕下方为回风系统。 洁净室内应保持一定的新鲜空气量 室内每人新鲜空气量不应小于40m3/h 。 实际使用中减少新风,以节约能耗,但前提是要保证人员舒适度,不能觉得闷。 也可选用总风量的15%左右作为新风量。 新风口过滤网要经常更换,应易于更换。 洁净室必须维持一定的正压 不同空气洁净度的洁净区之间以及洁净区与非洁净区之间的静压差不应小于10Pa。 同级别制备间和洁净走廊前者压力高于后者。 要考虑外排式生物安全柜开启后,增加的排气量对压差的影响。 工艺设计 体细胞生产的工艺流程不同于传统药物,规模小,多批同时进行,人为操作多,为了防止交叉错误,一个制备间同期只制备同一批样品为好。 分别设置人员和物料的进出口通道。 制备区不设上下水。如一更室设洗手池,则排出的洁净空气不要回风,直接外排不参加再循环为好。 涉及病毒污染样品,或应用病毒转基因细胞制剂,应考虑人和物单向流。 其他考虑 消毒设施(臭氧、UV灯、过氧化氢等)。 CO2管路,接口阀门。 闭路监视系统,压差、细胞库氮气监控。 尘埃粒子监控 对讲系统 物料、试剂、耗材等库房(待检、合格区)。 双路供电。 消防:消防设备,消防通道。 防鼠和蚊虫 污水处理 纯水制备 依据细胞制剂特性和生产制备工艺考虑细胞制剂间设计框架 1、非病毒细菌污染个体化细胞制备间,可与同级别洁净走廊直接相通。垃圾可在洁净走廊设统一的污物传递窗。 2、病毒阳性细胞,以及病毒转基因细胞制备间最好采 用人和物单向流,从洁净走廊进入制备间不再返回。生物安全柜采用外排式。 3、外界暴露过的组织细胞样品(脐带、胎盘等)进行 批量制备生产,应设立预处理间。预处理间、 人流、物流为独立机组。经检验合格的样品再传入生产制 备区。 4、洗消间人流、物流可设为独立区域机组。细胞制剂 不同于常规生物制药,通常采用一次性耗材,无需天天高温消毒物品,不用不开,可节省能源。 中国人大网公布了《中华人民共和国药品管理法(修订草案)》 第三十八条 开办药品生产企业,必须具备以下条件: (一)具有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人; (二)具有与其药品生产相适应的厂房、设施和卫生环境; (三)具有能对所生产药品进行质量管理和质量检验的机构、人员以及必要的仪器设备; (四)具有保证药品质量的规章制度,并符合国务院药品监督管理部门依据本法制定的药品生产质量管理规范要求。 有些属于个人看法仅供大家讨论参考 联系电话:18059820736
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||